Випаровування, конденсація, кипіння. Насичена і ненасичена пара
Випаровування, конденсація, кипіння.
Насичена і ненасичена пара.
Будь-яка речовина за певних умов може знаходитися в різних агрегатних станах - твердому, рідкому і газоподібному. Перехід з одного стану в інший називається фазовим переходом. Випаровування і конденсація є прикладами фазових переходів.
Всі реальні гази (кисень, азот, водень і т. д.) за певних умов здатні перетворюватися на рідину. Проте перетворення газу на рідину може відбуватися лише при температурах нижче визначеної, так званої критичної температури Tкр. Наприклад, для води критична температура рівна 647,3 К для азоту 126 К для кисню 154,3 К. При кімнатній температурі (біля 300 К ) вода можеперебувати і в рідкому і в газоподібному станаі, а азот і кисень - лише у вигляді газів.
Випаровуванням називається фазовий перехід з рідкого стану в газоподібний. З точки зору молекулярно-кінетичної теорії, випаровування - це процес, при якому з поверхні рідини вилітають найбільш швидкі молекули, кінетична енергія яких перевищує енергію їх зв'язку з рештою молекул рідини. Це приводить до зменшення середньої кінетичної енергії молекул, що залишилися, тобто до охолоджування рідини (якщо немає підведення тепла з навколишнього середовища).
Конденсація - це процес, обернений до процесу випаровування. При конденсації молекули пари пвертаються в рідину.
У закритій посудині рідина і її пара можуть знаходитися в стані динамічної рівноваги, коли число молекул, що вилітають з рідини, дорівнює числу молекул, що повертаються в рідину з пари, тобто коли швидкості процесів випаровування і конденсації однакові. Таку систему називають двофазною. Пару, що знаходиться в рівновазі зі своєю рідиною, називають насиченою.
Число молекул, що вилітають з одиниці площі поверхні рідини за одну секунду, залежить від температури рідини. Число молекул, що повертаються з пари в рідину, залежить від концентрації молекул пари і від середньої швидкості їх теплового руху, яка визначається температурою пари.
Звідси випливає, що для даної речовини концентрація молекул пари при рівновазі рідини і її пари визначається їх рівноважною температурою. Встановлення динамічної рівноваги між процесами випаровування і конденсації при підвищенні температури відбувається при вищих концентраціях молекул пари. Оскільки тиск газу (пари) визначається його концентрацією і температурою, то можна зробити висновок: тиск насиченої пари p0 даної речовини залежить лише від його температури і не залежить від об'єму. Тому ізотерми реальних газів на площині (p, V) містять горизонтальні ділянки, що відповідають двофазній системі
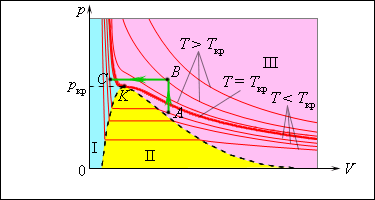 |
Ізотерми реального газу. Область I - рідина, область II - двофазна система «рідина + насичена пара», область III - газоподібна речовина. K - критична точка. |
При підвищенні температури тиск насиченої пари і його густина зростають, а густна рідини зменшуєтьсявнаслідок теплового розширення. При температурі, рівній критичній температурі T кр для даної речовини, густина пари і рідини стає однаковою. При T > T кр зникають фізичні відмінності між рідиною і її насиченою парою.
Якщо ізотермічно стискати ненасичену пару T < Tкр то її тиск зростатиме, поки не стане рівним тиску насиченої пари. При подальшому зменшенні об'єму на дні посудини утворюється рідина і встановлюється динамічна рівновага між рідиною і її насиченою парою.
Із зменшенням об'єму все більша частина пари конденсується, а її тиск залишається незмінним (горизонтальна ділянка на ізотермі). Коли вся пара перетворюється на рідину, тиск різко зростає при подальшому зменшенні об'єму унаслідок того, що рідина при збільшенні тиску практично не міняє свого об'єму..
З газоподібного стану в рідкий можна перейти, минувши двофазну область. Для цього потрібно зробити процес в обхід критичної точки K. Один з можливих процесів такого роду показаний на малюнку ламаною лінією ABC.
У атмосферному повітрі завжди присутні пари води при деякому парціальному тиску p який, як правило, менше тиску насиченої пари p0. Відношення p / p0виражене у відсотках, називається відносною вологістю повітря.
Тиск p0 насиченої пари дуже швидко зростає із зростанням температури T. Залежність p0(T) не можна отримати із законів ідеального газу. Тиск газу при постійній концентрації молекул зростає прямо пропорціонально температурі. У насиченій парі при підвищенні температури зростає не лише середня кінетична енергія руху молекул, але і їх концентрація. Тому тиск насиченої пари при підвищенні температури зростає швидше, ніж тиск ідеального газу при постійній концентрації молекул.
Випаровування може відбуватися не лише з поверхні, але і в об'ємі рідини. У рідині завжди є найдрібніші бульбашки газу. Якщо тиск насиченої пари рідини дорівнює зовнішньому тиску (тобто тиску газу в бульбашках) або перевищує його, рідина випаровуватиметься всередину бульбашок. Бульбашки, наповнені парою, розширюються і спливають на поверхню. Цей процес називається кипінням. Таким чином кипіння рідини починається при такій температурі, при якій тиск її насиченої пари стає рівним зовнішньому тиску.
Зокрема, при нормальному атмосферному тиску вода кипить при температурі 100 °С. Це означає, що при такій температурі тиск насиченої пари води рівний 1 атм. При підйомі в гори атмосферний тиск зменшується, і тому температура кипіння води знижується (приблизно на 1 °С на кожних 300 метрів висоти). На висоті 7 км. тиск складає приблизно 0,4 атмі температура кипіння знижується до 70 °С.
У герметично закритій судині рідина кипіти не може, т. до. при кожному значенні температури встановлюється рівновага між рідиною і її насиченою парою. По кривій рівноваги p0(T) можна визначати температури кипіння рідини при різних тисках.