Рівнянн стану ідеального газу. Рівняння Менделєєва-Клапейрона
РІВНЯННЯ СТАНУ ІДЕАЛЬНОГО ГАЗУ. РІВНЯННЯ МЕНДЄЛЄЄВА-КЛАПЕЙРОНА.
На минулих уроках ми розглянули випадки, коли один з трьох макропарметрів, які характеризують стан системи не змінюється. Ми вияснили, що якщо постійною є температура, то тиск і об'єм пов'язані законом Бойля-Маріотта, якщо постійний об'єм; то тиск і температура газу пов'язані законом Шарля; якщо постійний тиск, то об'єм і температура пов'язані законом Гей-Люссака.
Встановимо зв'язок між тиском, об'ємом і температурою деякої маси газу, коли змінюються усі три величини.
Нехай початковий об'єм, тиск і абсолютна температура деякої маси газу дорівнюють відповідно V1, р1 та Т1, а кінцеві - відповідно V2, р2 та Т2. Нехай перехід від першого стану до другого відбувався у два етапи. Припустимо, наприклад, спочатку змінився об'єм від V1 до V2, причому температура Т1 залишалась без змін. Новий тиск газу, який він матиме в кінці цього процесу позначимо р. Другим етапом, змінювалась температура від Т1 до Т2 при постійному об'ємі, при цьому тиск газу змінився від р до р2. Випишемо в стовпчик величини, які характеризують кожен з трьох станів системи:
V1, р1, Т1 - початковий (перший) стан системи І;
V2, р, Т1 - другий стан системи ІІ;
V2, р2, Т2 - третій стан системи ІІІ;
Для переходу системи з стану І в стан ІІ застосуємо закон Бойля-Маріотта, оскільки даний процес є ізотермічним:
![]() звідки
звідки ![]() (1)
(1)
Для переходу системи із стану ІІ в стан ІІІ застосуємо закон Шарля, оскільки даний процес є ізохоричним:
![]() (2)
(2)
Перемножимо рівняння (1) та (2) отримаємо:
![]() звідки
звідки ![]() або
або ![]()
Дане рівняння перепишемо в загальному вигляді, врахувавши, що значення V1, р1, Т1 та V2, р2, Т2 обрані довільним чином.
![]() або
або ![]() - рівняння Клапейрона
- рівняння Клапейрона
Такий самий висновок можна отримати використавши й іншу пару ізопроцесів. Спробуйте переконатись в цьому самостійно.
Отже, для даної маси газу добуток тиску газу на його об'єм пропорційний до абсолютної температури - це є рівняння Клапейрона.
Вдосконалив це рівняння відомий хімік Д.І. Менделєєв. Працюючи паралельно з Клапейроном він отримав таке ж рівняння. Крім того експериментально було встановлено, що коефіцієнт пропорційності в даному рівнянні залежить від кількості речовини. Після усіх вдосконалень рівняння стану ідеального газу набуло вигляду:
![]() - рівняння Мендєлєєва-Клапейрона (або рівняння стану ідеального газу)
- рівняння Мендєлєєва-Клапейрона (або рівняння стану ідеального газу)
де, m - маса газу;
![]() - молярна маса газу;
- молярна маса газу;
R - коефіцієнт пропорційності, який є однаковим для усіх газів і називається універсальною газовою сталою.
Вияснимо фізичний зміст універсальної газової сталої, для цього виразимо її з рівняння Менделєєва-Клапейрона.
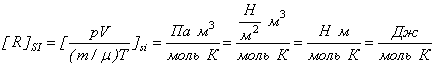
Отже,
Універсальна газова стала ([R]= ![]() )- це фізична величина, яка чисельно рівна роботі, яку потрібно виконати над ідеальним газом з кількість речовини 1 моль, щоб змінити його температуру на 1 кельвін.
)- це фізична величина, яка чисельно рівна роботі, яку потрібно виконати над ідеальним газом з кількість речовини 1 моль, щоб змінити його температуру на 1 кельвін.
Експериментальні дослідження показали, що R=8,314![]()
ЦІКАВО ЗНАТИ
Рівняння стану - є узагальненим рівняння для всіх трьох раніше отриманих нами газових законі. Слід наголосити, що розв'язуючи будь-яку фізичну задачу, рівняння стану слід записати для КОЖНОГО з станів в яких перебуває система.
Покажемо, що з рівняння Мендєлєєва-Клапейрона можна отримати усі газові закони.
Нехай ідеальний газ, з незмінною кількістю речовини ![]() в початковому стані характеризується макропараметрами V1, р1 та Т1, а в кінцевому стані - відповідно V2, р2 та Т2.
в початковому стані характеризується макропараметрами V1, р1 та Т1, а в кінцевому стані - відповідно V2, р2 та Т2.
ІЗОТЕРМІЧНИЙ ПРОЦЕС, тобто Т1= Т2. Запишемо рівняння стану ідеального газу для двох станів:
Для стану І - ![]() (1)
(1)
Для стану ІІ - ![]() (2)
(2)
Оскільки у рівняннях (1) та (2) праві частини рівні, то й праві частини рівні, тоді можна записати, що ![]() - ми отримали закон Бойля-Маріотта.
- ми отримали закон Бойля-Маріотта.
ІЗОБАРИЧНИЙ ПРОЦЕС, тобто р1= р2. Запишемо рівняння стану ідеального газу для двох станів:
Для стану І - ![]() (3)
(3)
Для стану ІІ - ![]() (4)
(4)
Поділимо рівняннях (3) на (4) , тоді
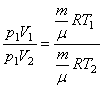 звідки
звідки ![]() або V~T. Ми отримали закон Гей-Люссака
або V~T. Ми отримали закон Гей-Люссака
ІЗОХОРИЧНИЙ ПРОЦЕС, тобто V1= V2. Запишемо рівняння стану ідеального газу для двох станів:
Для стану І - ![]() (5)
(5)
Для стану ІІ - ![]() (6)
(6)
Поділимо рівняннях (5) на (6) , тоді
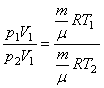 звідки
звідки ![]() або р~T. Ми отримали закон Шарля
або р~T. Ми отримали закон Шарля