Ізотермічний процес. Закон Бойля-Маріотта
ІЗОТЕРМІЧНИЙ ПРОЦЕС
Розглянемо питання про те, як змінюється тиск газу при зміні його об'єму при ізотермічному процесі, тобто коли маса, молярна маса і температурі газу залишаються незмінними. Даний дослід можна змоделювати наступним чином: циліндр, який з одного кінця запаяний, а з іншого закритий рухомим поршнем. Якщо поршень повільно рухати всередині циліндра, то газ під поршнем зазнаватиме ізотермічного розширення або стиску. Повільний рух поршні забезпечить час для перебігу процесу теплообміну газу і навколишнього середовища, в результаті чого температура газу під поршнем завжди залишатиметься сталою. Слід відмітити, що при ізотермічному процесі газ завжди знаходиться в термодинамічній рівновазі з навколишнім середовищем, температура.
Під час повільного стиснення газу поршнем, тиск газу збільшувався пропорційно до зменшення об'єму даного газу;
ØІ навпаки під час повільного розширення газу, тиск газу зменшувався пропорційно до збільшення його об'єму.
Цей висновок незалежно один від одного отримали два науковці: англійський фізик і хімік Роберт Бойль (1627 - 1691) та французький фізик Едмон Маріотт (1620 - 1684). Даний висновок названий законом Бойля-Маріотта і звучить так:
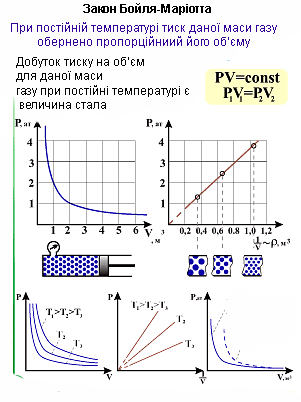
При ізотермічному процесі тиск газу обернено пропорційний до його об'єму.
Якщо позначити початковий і кінцевий об'єми газу при ізотермічному процесі як V1 та V2, а початковий і кінцевий тиски, як р1 та р2, то на основі дослідів Бойля і Маріотта можна записати таке співвідношення:
![]() звідки
звідки ![]()
Оскільки об'єми та відповідні їм тиски були вибрані довільним чином, то можна записати закон Бойля-Маріотта так
![]() або
або ![]() (1)
(1)
Використовуючи останнє співвідношення закон Бойля-Маріотта можна сформулювати ще й так:
При ізотермічному процесі добуток тиску газу на його об'єм є незмінною величиною.
Слід відмітити, що закон Бойля-Маріотта виконується з великим ступенем точності для розріджених газів. Для газів, які знаходяться під високим тиском даний закон використовувати недоцільно.
Фізичний зміст закону Бойля-Маріотта досить легко зрозуміти, якщо побудувати графік залежності тиску газу від його об'єму при ізотермічному процесі. Як видно із формули (1)
![]() звідки
звідки ![]()
Залежність тиску від об'єму є обернено пропорційною, отже, графіком залежності є гіпербола.
Кожна точка гіперболи характеризується певними значеннями об'єму V та тиску р. І для кожної точки графіка добуток ![]() є сталим. Тобто, перпендикуляри опущені на осі координат з довільної точки графіка разом з осями координат утворюють рівновеликі прямокутники (прямокутники, площі яких однакові).
є сталим. Тобто, перпендикуляри опущені на осі координат з довільної точки графіка разом з осями координат утворюють рівновеликі прямокутники (прямокутники, площі яких однакові).
Пояснимо закон Бойля-Маріотта, використовуючи положення молекулярно-кінетичної теорії. Оскільки температура газу при ізотермічному процесі не змінюється, то швидкість руху молекул газу теж є сталою під час всього процесу. Отже, тиск газу залежить лише від кількості ударів молекул об стінки посудини. Як Ви вже знаєте з доведення основного рівняння молекулярно-кінетичної теорії, тиск газу пропорційний до кількості молекул, що припадають на одиницю об'єму газу. Оскільки при розширенні газу (збільшенні його об'єму) кількість молекул залишається сталою, а об'єм газу збільшується, то концентрація молекул газу зменшуватиметься, відповідно зменшуватиметься і кількість ударів молекул, що припадатимуть на одиницю площі поверхні стінок посудини, отже, тиск газу зменшуватиметься.
І навпаки, якщо ми будемо стискати газ, то концентрація його молекул буде зростати, оскільки зі зменшенням об'єму газу відстані між молекулами ставатимуть все меншими. Зі збільшенням кількості молекул, що припадають на одиницю об'єму газу, збільшуватиметься і кількість ударів цих молекул об стінки посудини. Отже, тиск газу зростатиме.
Чому ж закон Бойля-Маріотта не справджується для газів під великим тиском? Справа в тому, що даний закон був відкритий для ідеального газу. Нагадаємо, що для ідеального газу ми нехтуємо розмірами молекул і їх електричною взаємодією, оскільки відстані між молекулами газу набагато більші за їх розміри. Коли газ знаходиться під великим тиском, то відстані між молекулами стають малими і спів розмірними з розмірами самих молекул, тому в цьому випадку нехтувати розмірами самих молекул і силами міжмолекулярної взаємодії вже не можна. Томі для газів під великим тиском закон Бойля-Маріотта не справджується.
t