Ідеальний газ. Температура
Ідеальний газ
Основними об'єктами досліджень молекулярної фізики є гази. Усі гази складаються з молекул, які мають розміри, хоч і надзвичайно малі. Крім того молекули постійно взаємодіють на відстані. А це вже величини, які потрібно враховувати. Це зробило б обрахунки дуже громіздкими. Саме тому знадобилась деяка ідеалізована модель газу, на яку можна було б спиратись при роботі з реальними газами. Саме такою моделлю став ідеальний газ. Молекули ідеального газу, на відміну від молекул реального, вважаються матеріальними точками, тобто мають нескінченно малі розміри. До того ж сили міжмолекулярної взаємодії відсутні, і молекули взаємодіють лише при співударах.В природі немає нічого ідеального. Не існує також і ідеального газу. Але таке введення дозволяє вивести закони, справедливі і для реальних газів.
Температура і її вимірювання.
Ви мабуть часто зустрічались із таким поняттям, як температура. І дійсно, ця величина дуже важлива для нашого життя. Кожен день люди взнають з прогнозу погоди, яка температура очікується. Температура тіла слугує важливим індикатором стану людини. Вимірюють температуру термометрами. Існують різні види термометрів: ртутні, спиртові, електронні, і всі вони мають своє застосування.



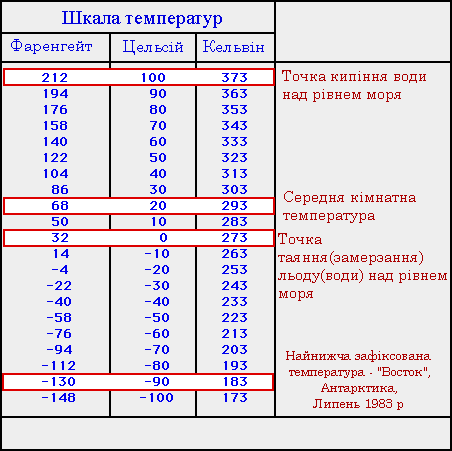
Вам мабуть відомо, що існують різні шкали вимірювання температури. У повсякденному житті найчастіше користуються шкалою Цельсія (окрім деяких країн, де більш поширена шкала Фаренгейта), яка названа так на честь шведського астронома А.Цельсія, який запропонував її. Він виходив з таких міркувань: взявши деяке тіло він занурив його у воду з льодом. Прийняв цю температуру за 0° і виміряв об'єм V0 тіла. Потім довів воду до кипіння і знов занурив тіло. При цьому воно розширилось. Цельсій знову виміряв об'єм V100 тіла, і прийняв дану температуру за 100°. Таким чином можна знайти зміну об'єму, що припадає на один градус, тобто:
Отже, один градус - це сота частина різниці між температурами замерзання і кипіння чистої води при атмосферному тиску.
Щоб перевести температуру із шкали Цельсія у шкалу Фаренгейта використовують наступну формулу:
У фізиці втім найпоширенішою є шкала Кельвіна, або абсолютна температурна шкала. Щоб знайти температуру за шкалою Кельвіна, або абсолютну температуру, потрібно до градусі Цельсія додати 273,15:
Але що ж це насправді таке - температура?
Найпростіше на це питання можна відповісти так: це міра нагрітості тіл. Це означає, що більш нагріті тіла мають більшу температуру, і навпаки. Це, взагалі то, правильно, але не досить точно.
Пояснення температури і тиску газу на основі молекулярних уявлень.
Відомо, що температура тіла пов'язана із швидкістю його молекул. А отже і з їхньою кінетичною енергією. Можна дати наступне означення: температура - це міра середньої кінетичної руху молекул. Це твердження виражається формулою:
де k - стала Больцмана. Її величина визначена експериментально:
Тепер, знаючи вираз для середньої кінетичної енергії легко зрозуміти зміст температури, які називають абсолютним нулем. Видно, що при цій температурі кінетична енергія молекул стає також рівною нулю, отже припиняється їх тепловий рух. Але молекули продовжують коливатися навіть при цій температурі.Температура характеризує систему багатьох молекул, тобто не має змісту питання про температуру однієї чи кількох молекул. Отже, це - макроскопічна величина.Тепер розглянемо природу тиску газу. Якщо газ вміщено у деяку закриту посудину, то його молекули постійно вдаряються о стінки. Звичайно, ці удари кожен окремо дуже короткочасні і слабкі, але якщо взяти до уваги те, що таких ударів одночасно дуже багато і вони часті і те, що молекули рівномірно розміщені по всьому об'єму, то стає зрозумілим, що загальна сила може бути досить великою. Саме ця сила і тисне на стінки посудини.

