Контрольна робота
- Маса 11,2 л суміші чадного і вуглекислого газів становить 20 г (н.у.). Обчислити масові частки газів у суміші.
- Чи вистачить 10,26 г барій гідроксиду для добування 11,65 г барій сульфату? Відповідь підтвердьте розрахунками. Запропонуйте якомога більше способів добування магній ортофосфату. Напишіть рівняння відповідних реакцій та вкажіть умови їх перебігу.
- При деякій температурі відносна густина пари сірки за азотом дорівнює 9,14. Вкажіть кількісний склад молекули сірки.
- На відновлення 7,09 г оксиду двовалентного металу витрачається 2,24 л водню (н.у.) Визначити метал. Обчислити еквівалентну масу металу та його оксиду.
- Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
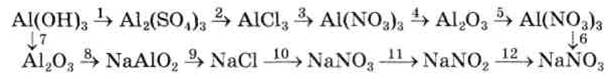
- Пояснити залежність кислотно-основних властивостей оксидів та гідроксидів від ступеня окиснення атомів елементів що їх утворюють. Які гідроксиди називають амфотерними?
- Який елемент утворюється із радіоактивного ізотопа свинцю Pb шляхом послідовного розпаду, що супроводжується β-→ α → β- випромінюванням?
- Природний літій складається з ізотопів 7Li та 6Li. Масова частка першого нукліду становить 92,58%. Обчисліть відносну атомну масу літію з точністю до десятих.
- З якими з перелічених речовин реагуватиме хлоридна кислота: N2O5, Zn(OH)2, CaO, AgNO3, H3PO4, H2SO4, Cu(OH)2? Напишіть хімічні рівняння відповідних реакцій.
- Відомо, що в ряду NH3, HF, H2O спостерігається зростання температури кипіння речовин. Поясніть це явище.