Проект "Роль ферментів в житті та хоз. діяльності людини "
На цій сторінці поділіться інформацією про важливі ферменти в житті живих організмів.
трипсин
(Restore this version)
Modified: 15 October 2016, 5:35 PM User: Клеймёнова Юлия →
Здесь мы будем собирать информацию про фермент трипсин!
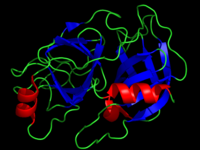
Трипсин — фермент класса гидролаз, расщепляющий пептиды и белки, обладает также эстеразной (гидролиз сложных эфиров) активностью.
Трипсины относятся к группе сериновых протеаз и содержат в активном центре остатки серина и гистидина. Трипсины легко подвергаются самоперевариванию (аутолизу), что приводит к загрязнению препаратов трипсинов неактивными продуктами (промышленный препарат содержит до 50 % неактивных примесей). Препараты трипсина высокой чистоты получают хроматографическими методами.
Физические свойства
Трипсин представляет собой бесцветное кристаллическое вещество с температурой плавления около 150 °C.
(Григоренко)
Биологические свойства и функции
Основной функцией является пищеварение. Катализирует гидролиз белков и пептидов. Может находиться в неактивном состоянии в виде трипсиногена. Активируется, в том числе кишечным ферментом энтеропептидазой, путём отщепления гексапептида. Катализирует также гидролиз восков-сложных эфиров. Оптимум каталитической активности — при pH 7,8—8. Активный центр имеет белковую природу и состоит в основном из серина и гистидина. Синтезируется в виде трипсиногена в поджелудочной железе и используется в кишечнике млекопитающих и рыб. Превращает остальные проферменты гидролаз в активные ферменты.
Применение
Трипсин используют для изготовления лекарств. Препараты трипсина обладают противовоспалительным и противоотёчным действием (при внутривенном и внутримышечном введении); способны избирательно расщеплять ткани, подвергшиеся некрозу. В медицине трипсин применяют для лечения ран, ожогов, тромбозов, часто в сочетании с другими ферментами и с антибиотиками. Используется при анализе первичной структуры белка, за счет того, что он селективно гидролизует связи после остатков положительно заряженных аминокислот лизина и аргинина.
Изменение гидролитических свойств
Активность трипсина подавляется фосфорорганическими соединениями, некоторыми металлами, а также рядом высокомолекулярных белковых веществ — ингибиторов трипсина, содержащихся в тканях животных, растений и микроорганизмов. Ионы Ca2+, Mg2+, Ba2+, Sr2+, Mn2+ повышают гидролитическую активность трипсина.

(Вальтер)
Родственные ферменты
«Ближайшие родственники» трипсина — трипсиноген, пепсин, химотрипсин. У высших животных обнаружены анионные аналоги трипсина, у многих животных и растений-нейтральные.
Медицина
При применении трипсина иногда могут отмечаться болезненность и гиперемия в месте введения, аллергические реакции, повышение температуры тела, тахикардия, раздражение слизистых оболочек, осиплость голоса.
Противопоказания к назначению трипсина: декомпенсация сердечной деятельности, эмфизема легких с дыхательной недостаточностью, декомпенсированные формы туберкулеза легких, дистрофия и цирроз печени, вирусный гепатит, поражения почек, панкреатит, геморрагический диатез. Трипсин нельзя вводить в очаги воспаления и кровоточащие полости, наносить на изъязвленную поверхность злокачественных опухолей.
(Клеймёнова)